ESTUDIOS CLÍNICOS
LIBERTY AD ADOL

Dupilumab en adolescentes con dermatitis atópica moderada a severa con control inadecuado: Estudio de fase 3, aleatorizado, doble ciego, comparado con placebo en grupos paralelos.
AUTORES: E.L. Simpson, A.S. Paller, E.C. Siegfried, M. Boguniewicz, L. Sher, M.J. Gooderham, L.A. Beck, E. Guttman-Yassky, D. Pariser, A. Blauvelt, J. Weisman, B. Lockshin, T. Hultsch, Q. Zhang, M.A. Kamal, J.D. Davis, B. Akinlade, H. Staudinger, J.D. Hamilton, N.M.H. Graham, G. Pirozzi, A. Gadkari, L. Eckert, N. Stahl, G.D. Yancopoulos, M. Ruddy, y A. Bansal
DUPIXENT está indicado para el tratamiento de pacientes a partir de los 12 años de edad con dermatitis atópica severa no controlada con un tratamiento sistémico clásico o cuyo uso se encuentra contraindicado.*
Evaluó la eficacia y la seguridad de la monoterapia con DUPIXENT en adolescentes con dermatitis atópica moderada a severa con control inadecuado.
 Diseño del estudio
Diseño del estudio
Estudio multicéntrico, aleatorizado, comparado con placebo, doble ciego, en grupos paralelos, de fase 3.
La dosis de DUPIXENT aprobada es de 300 mg Q2W SC para los adolescentes ≥60 kg, o de 200 mg Q2W SC para los adolescentes <60 kg. Las terapias tópicas y otras terapias para la dermatitis atópica sistémica estaban prohibidas, pero se permitían como tratamiento de rescate para los síntomas intolerables.
* Los pacientes <60 kg recibieron 200 mg después de una dosis de carga de 400 mg. Los pacientes ≥60 kg recibieron 300 mg después de una dosis de carga de 600 mg.
• ≥ 12 años de edad a ≥ 18 años de edad
• ≥1 año de dermatitis atópica
• Puntaje IGA ≥3
• Puntaje EASI ≥16
• Proporción de pacientes que alcanzaron un EASI-75 (≥75% de mejora desde el inicio) a las 16 semanas
• Proporción de pacientes con IGA 0 o 1 (aclaramiento total o casi total de la piel) y una mejora de ≥2 puntos desde el inicio a las 16 semanas
• Proporción de pacientes con ≥4 puntos de mejora en el puntaje NRS pico del prurito a las 4 y 16 semanas
• Cambio promedio desde el inicio hasta las 16 semanas en:
- Puntaje NRS prurito (%; a las 4 y 16 semanas)
- Puntaje CDLQI
- Puntaje SCORAD (%)
- Puntaje EASI (%)
- Puntaje POEM
AD, dermatitis atópica; CDLQI, Índice de la Calidad de Vida Dermatológica en Niños; EASI, Índice de gravedad y área del eczema; IGA, Evaluación Global del Investigador; LS, cuadrados mínimos; NRS, Escala de puntaje numérica; POEM, Medida de eccema orientada al paciente; Q2W, una vez cada 2 semanas; Q4W, una vez cada 4 semanas; QoL, calidad de vida; SC, subcutánea; SCORAD, Puntaje de la dermatitis atópica; SE, error estándar; SOC, clase de sistema y órganos.
 Eficacia
Eficacia
~42% de los pacientes alcanzaron una mejora a ≥75% en la extensión y la severidad de las lesiones con DUPIXENT en el grupo de tratamiento Q2W a las 16 semanas (P<0,001 vs placebo)**
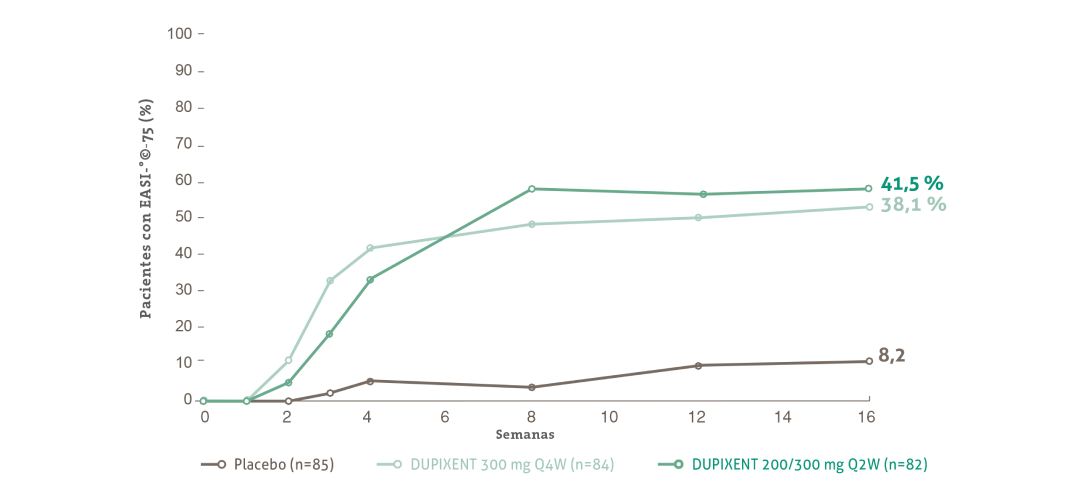
** La dosis de DUPIXENT aprobada es de 300 mg Q2W para los adolescentes ≥60 kg, o de 200 mg Q2W para los adolescentes <60 kg.
• En total, un 24% de los pacientes que recibieron DUPIXENT lograron aclaramiento total o casi total de la piel a las 16 semanas vs 2,4% de los pacientes que recibieron placebo (P<0,001)
• Los pacientes lograron un 48% de mejora media en el puntaje NRS pico del prurito con DUPIXENT a las 16 semanas vs 19% de los pacientes que recibieron placebo (P<0,001
• Se observó una mejora significativamente mayor en la calidad de vida relacionada con la salud en los pacientes que recibieron DUPIXENT vs placebo, de acuerdo con el cambio en el LS medio (SE) del CDLQI desde el inicio hasta las 16 semanas (-8,5 [0,50] vs -5,1 [0,62]; P<0,001)
— Blauvelt et al. Lancet, 2016
 En pacientes adolescentes con dermatitis atópica moderada a severa, DUPIXENT proporcionó una mejora significativa en:
En pacientes adolescentes con dermatitis atópica moderada a severa, DUPIXENT proporcionó una mejora significativa en:
• La extensión y severidad de las lesiones de la piel
• Intensidad del prurito
• Medidas de la calidad de vida
 Seguridad y tolerabilidad
Seguridad y tolerabilidad
• No hubo interrupciones debido a eventos adversos con DUPIXENT (0% vs 1,2% con placebo)
• Es un inmunomodulador específico, no un inmunosupresor amplio ni un tratamiento esteroideo
• No requiere análisis de laboratorio inicial ni monitoreo para detectar toxicidad de órganos
• No se informaron eventos adversos serios con DUPIXENT (0% vs 1,2% con placebo)
• Los eventos adversos más comunes con DUPIXENT (aquellos que se presentaron en ≥5% de los pacientes) fueron:
- Infecciones cutáneas no herpéticas*
- Infección de tracto respiratorio superior*
- Dolor de cabeza
- Conjuntivitis
- Infecciones e infestaciones *
- Reacciones en el sitio de inyección
* Ocurrieron en frecuencia numéricamente menor en la rama DUPIXENT Q2W que en la rama placebo.
† Incluye los siguientes términos preferentes: queratoconjuntivitis atópica, conjuntivitis, conjuntivitis alérgica, conjuntivitis bacteriana y conjuntivitis viral.
Publicado en JAMA Dermatology 2019. JAMA Dermatol. 2020;156(1):44-56. doi:10.1001/jamadermatol.2019.3336